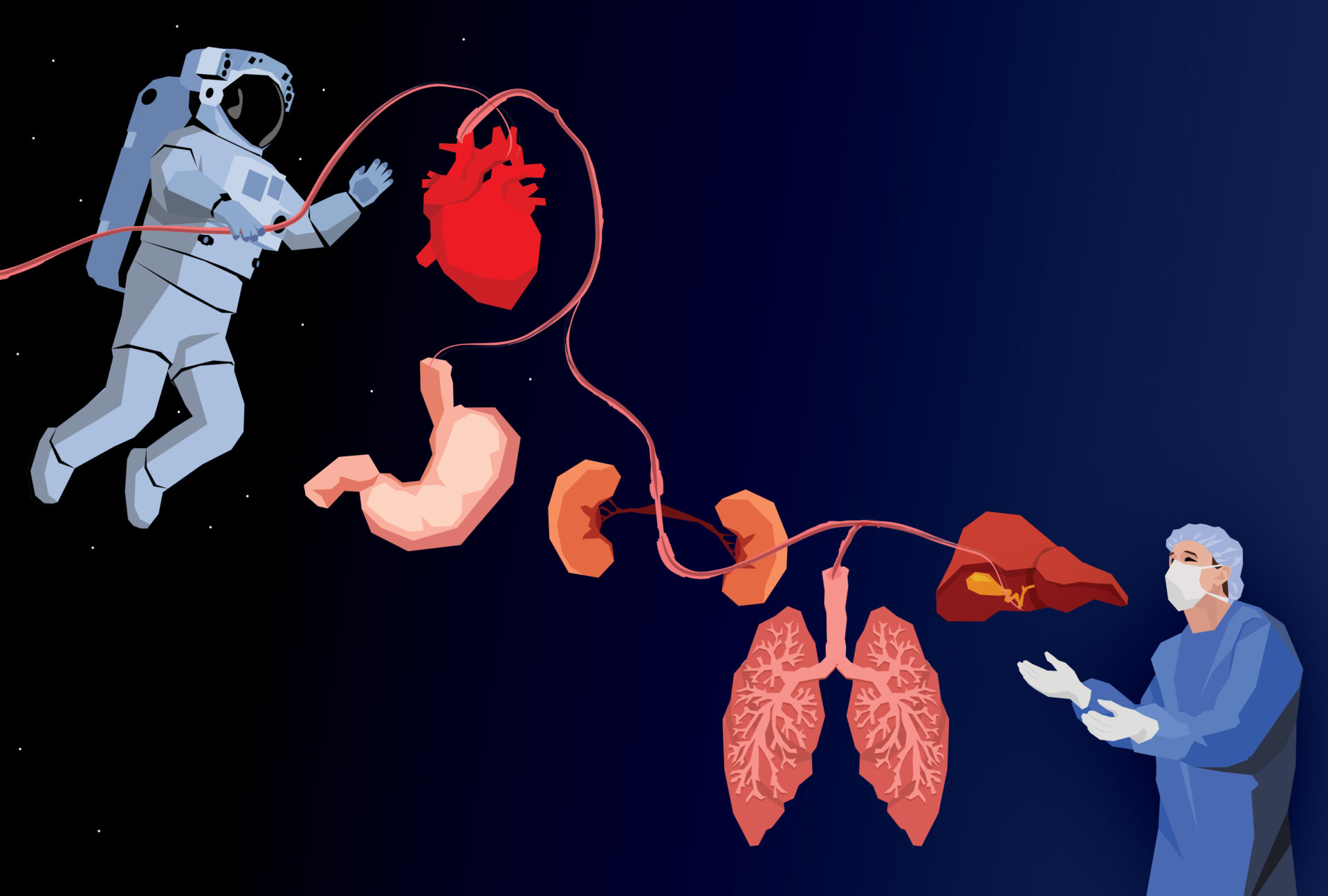
Тканинна інженерія — це сукупність біотехнологічних підходів, що спрямовані на відтворення структури та функцій тканин і органів поза межами організму за допомогою різноманітних інструментів. Одним із них є культивування клітин, часто не лише у так званому культуральному посуді (як для інших біотехнологічних цілей), а в об’ємних структурах, створених із елементів позаклітинного матриксу або аналогічних їм речовин. Такі структури можуть бути надруковані на 3D-принтері чи створені іншим способом. Ми часто чуємо вислів «вирощування органів», але варто наголосити, що процес створення тканинно-інженерних конструкцій дуже складний, тому слово «вирощування» не зовсім підходить для його опису. Однак терміну, який би було так само зручно застосовувати у побуті, поки немає, тому далі ми спробуємо провести деякі паралелі з вирощуванням рослин на городі.
Станом на 21 липня 2021 року 574 людини здійснили подорож у космос. Щодня ми все частіше чуємо про розробку біотехнологій у позаземних умовах і перспективи перебування на інших планетах.

Магазин від Universe Space Tech
Шкарпетки Космічна Капібара – Маленькі Капі
До товаруНа поверхні Землі сила тяжіння постійна, і хоча її точна величина залежить від місця розташування, стандартне значення прискорення під дією земної гравітації становить 9,81 м/с². На Міжнародній космічній станції (МКС) астронавти перебувають у стані вільного падіння, оскільки будь-який космічний корабель, що знаходиться на навколоземній орбіті, повинен рухатися з такою швидкістю, щоб його відхилення від прямої під дією гравітаційного прискорення відповідало кривизні поверхні планети (точніше, кривизні орбіти на відповідній висоті). Завдяки цьому сили, які діють на всі предмети та членів екіпажу орбітального комплексу, в мільйони разів менші, ніж у земних умовах. Такий стан називають невагомістю або, точніше, мікрогравітацією. Він ідеально підходить для вивчення впливу відсутності сили тяжіння на живі системи, у тому числі — для дослідження їх росту та розвитку як на клітинному рівні (у клітинній культурі), так і у складних системах, де для побудови тканинної архітектури можуть знадобитися різні нові підходи, в тому числі додаткові каркаси. Але вже є дані про певні переваги роботи з клітинами в умовах мікрогравітації. Так, виявилося, що стовбурові клітини у таких умовах яскравіше проявляють свою «стовбуровість», а деякі клітини, що вже ніби встигли «обрати свою долю» (спеціалізацію), можуть навіть дедиференціюватися — тобто «відкотитися до попередніх налаштувань».
Зі словом «вирощування» виникає декілька асоціацій. Так, для розведення якогось овоча нам зазвичай потрібне насіння. У тканинній інженерії його замінюють клітини. Для роботи можуть використовуватися як стовбурові, так і спеціалізовані клітини. Перші з них — тема окремої статті, адже вони поділяються на кілька типів із принципово різними властивостями та потенційною широтою перетворень. Головне, що відрізняє стовбурову клітину від спеціалізованої «робочої конячки» — це здатність перетворюватися на інші типи клітин і асиметрично ділитися (тобто давати при поділі не дві однакові клітини, а одну диференційовану й одну таку саму стовбурову).

Продовжуючи «агропорівняння», насіння потрібно висадити у певний ґрунт. Його роль у тканинній інженерії виконують різноманітні матриці та каркаси. Сьогодні вченим доступна величезна кількість матеріалів для таких структур. Це синтетичні, натуральні, біодеградабельні (тобто такі, що самі розчиняються з часом після потрапляння у живий організм) і стійкі. Залежно від завдання інколи потрібно, щоб матеріал лише надав структурі певної форми та дав можливість оптимально розташуватися клітинам, а далі доцільніше, щоб він зник без шкоди. Іноді бажано, щоб він довго залишався у тілі та був міцним. Але просто вкинути насінину в землю — не гарантія появи життєздатної рослини. Грунт потрібно удобрювати. Для створення тканинно-інженерної конструкції необхідно контролювати фактори, що змушують стовбурову клітину перетворитися на певний, запланований саме в цьому місці, тип клітин. Тому під час роботи застосовують різні індукуючі фактори — цитокіни, гормони, складні коктейлі з речовин, які надсилають клітинам сигнал, що саме тут і саме зараз має сформуватися саме така тканина. Також, звичайно, за всіма описаними процесами необхідний контроль. Такі роботи потребують неймовірно дорогого обладнання і висувають дуже високі вимоги до безпеки та чистоти.
Органоїди — надзвичайно важливий для фундаментальної біології та медицини об’єкт досліджень. По суті, це мікроскопічні або дуже маленькі ділянки певного органа, що сформовані кількома типами клітин у культурі. Такі «кульки» чи «пластинки» з клітин використовуються для вивчення процесів, що відбуваються під час формування певної тканини чи органа, дозволяють дослідити складні міжклітинні взаємодії та вплив різних факторів на утворення конкретних структур. За допомогою органоїдів можна зрозуміти, як розвивається орган під час ембріогенезу або як він регенерує за потреби. А ще на них можна моделювати різні патологічні процеси. Адже розуміння того, як усе відбувається, може допомогти знайти «мішені» для лікування. Також важливою є можливість впливати на «хворий» органоїд різними речовинами та тестувати доцільність їхнього застосування при змодельованих патологіях. На жаль, дуже часто саме роботу з органоїдами некваліфіковані ЗМІ видають за «вирощені органи». Нещодавно одна лабораторія змогла створити органоїд для вивчення перебігу нейродегенеративних захворювань, а його вже встигли оголосити «дорослим мозком у пробірці».
Ще один широковідомий напрямок — 3D-друк. Часто ми чуємо про «надруковані органи», й тут також варто дещо уточнити. За допомогою 3D-принтера можна створювати каркаси та матриці для тканинно-інженерних конструкцій. Для цього моделюється форма потрібного органа, застосовується біосумісний матеріал і формується необхідна «болванка». У деяких випадках для відновлення структури достатньо замістити втрачену частину таким фрагментом, і з часом власні клітини «обживуть» його. Так вдавалося зробити при відновленні носа та вух. Інколи надруковану форму додатково заповнюють стовбуровими клітинами та чекають на успішне «заселення» і перетворення під впливом індукуючих факторів на потрібну тканинну композицію. У цих випадках ідеться про друк виключно «неживого» компоненту, і такі роботи вже досить популярні у сфері регенеративної медицини. Іншим підходом є власне «біодрук» — коли структура формується 3D-принтером, у якому роль «чорнил» грають живі клітини. З цього приводу є низка скептичних зауважень, адже умови, за яких відбувається процес друку, не зовсім прийнятні для підтримання життєздатності клітин. Сьогодні «друкуються» лише міні-копії органів, що можуть бути корисними для фундаментальної науки й моделювання певних станів, але не для трансплантації людям. Однак 2019 року саме на борту МКС вдалося зробити важливий крок у біопринтингу в умовах мікрогравітації — були «надруковані» фрагменти мишачої щитоподібної залози. Дослідження в цьому напрямку активно тривають.

Необхідно зазначити, що всі успіхи у створенні органів поза межами організму обмежуються лише можливістю відтворити фрагмент повноцінного органа (кишківника, печінки тощо), а не створити повністю автономний орган, що, як у фантастичному фільмі, можна просто принести на тарілочці в операційну. Якщо з хрящами чи порожнистими структурами на кшталт сечового міхура, що складаються з декількох типів клітин, ситуація здається оптимістичною і ми справді можемо сподіватися на швидке введення в рутинну практику способів їхньої заміни, то зі складними багатошаровими органами, що мають специфічну архітектоніку, все не так просто. В цьому напрямку для сучасної тканинної інженерії існує кілька каменів спотикання. Перший — це васкуляризація, тобто проникнення кровоносних судин. Це значна проблема, але потроху її вирішують комбінуванням клітинних типів і внесенням попередників клітин, що формують судини. Найоригінальніший спосіб був описаний кілька років тому: для васкуляризації застосували судинну систему рослин — у прямому сенсі виростили кардіоміоцити (клітини серця) на підготованих листочках шпинату з розвинутим жилкуванням. Швидше за все, питання васкуляризації новостворених органів буде вирішене раніше за інші.
Друга проблема — іннервація, тобто проникнення в орган нервових закінчень. Тут усе складніше, однак позитивні зрушення також є. Третє питання, з приводу якого точаться найзапекліші дискусії, стосується центральної регуляції діяльності кожного з наших органів. Коли ми формуємося з двох клітинок і далі впродовж нашого життя розвиваємось, усі процеси регулюються на кількох рівнях, головним із яких є нейрогуморальний, тобто пов’язаний із нервовою системою та гормонами. Клітини «спілкуються» між собою за допомогою хімічних і електричних сигналів, кожен орган знає, чому він розташований саме тут і перебуває саме в такому стані, що він має робити та які сигнали передавати іншим структурам. Усе переплетено на багатьох рівнях розуміння. І якщо імунне питання «свій-чужий» можна вирішити, просто взявши для створення органа власні клітини (щоправда, це також не завжди можливо, але існують підходи з застосуванням клітин, що не несуть маркерів імунної відповіді, тому це питання також можна вважати хоча б частково вирішуваним), то спосіб уведення до надзвичайно тонкої та взаємопереплетеної системи взаємодій нового компоненту, що створювався поза межами компетентності нейрогуморального регулятора конкретного організму, значно складніший. По суті, створення навіть ідеального органа в лабораторії не дає гарантії його беззаперечного «прийняття у родину» самим організмом. Можливо, саме дослідження в умовах мікрогравітації — реальної у космосі чи штучно створеної на короткий час у спеціальних лабораторіях на літаках — дозволять зробити ключовий крок у подоланні хоча б деяких проблем, що виникають у галузі тканинної інженерії сьогодні.

В ході обговорення всіх цих питань в огляді 2016 року в журналі Nature з’явилося припущення стосовно подальшого розвитку клітинної інженерії: або ми продовжуємо йти тими же шляхами й чекаємо на розвиток наявних технологій (біодруку, компонування тканин зі стовбурових клітин тощо), або вже найближчим часом з’явиться певна революційна технологія, що, ймовірно, стратегічно відрізнятиметься від нині відомих підходів. Огляд 2019 року від тих же авторів зазначає, що тканинно-інженерні напрямки стають дедалі ближчими до клініки (у тому числі через зміни в регуляторних підходах), але досі лишаються здебільшого експериментальними, а не рутинними. Хоча, звичайно, впровадження їх у медичну практику є лише питанням часу.
Тільки найцікавіші новини та факти у нашому Telegram-каналі!
Долучайтеся: https://t.me/ustmagazine